What 2025 FDA Warning Letters Tell Us About GMP Compliance
2025년 1월 1일부터 12월 9일까지 공개된 의약품 완제의약품 제조업체 대상 미국 FDA 워닝레터를 검토하여, 주요 규제 준수 동향과 지역별 차이를 분석하였다. 총 85건의 워닝레터를 검토한 결과, 가장 빈번하게 지적된 규제 미준수 사항뿐만 아니라, 특히 데이터 완전성(Data Integrity)과 관련된 위반 유형에서 뚜렷한 지역적 패턴이 확인되었다.
또한, 21 CFR Part 211의 조항별로 가장 자주 인용된 항목을 매핑함으로써, 품질 시스템이 취약한 영역과 선제적인 시정·개선 활동이 집중되어야 할 부분을 도출하였다. 워닝레터의 59%는 미국 내 제조시설에 발부되었으며, 그 다음으로는 중국, 인도, 캐나다, 터키 소재 시설이 뒤를 이었다.
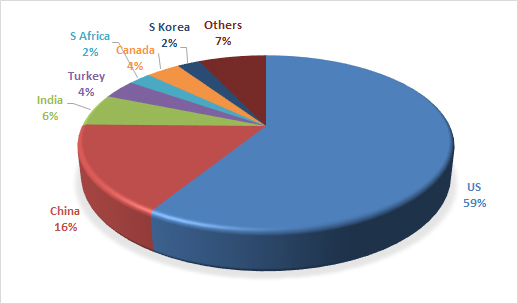
Figure 1: 2025 Drug Product Site Warning Letters
특히 데이터 완전성(DI) 관련 지적 사항에서 주목할 만한 시사점이 도출되었다. 전체 검토 대상 워닝레터 중 15%에서 DI 관련 문제가 지적되었으나, 이러한 지적은 지역별로 균등하게 분포되어 있지 않았다. 인도 소재 제조소는 DI 이슈가 동반된 워닝레터를 60%의 비율로 수령하여, 미국(10%) 및 중국(21%) 소재 제조소에 비해 현저히 높은 수준을 보였다. 이러한 뚜렷한 격차는 데이터 완전성이 특정 지역의 제조 환경에서 구조적인 과제로 작용하고 있을 가능성을 시사하며, 이는 품질 문화의 차이를 반영하는 결과일 수 있다.
또한, FDA가 전체 워닝레터의 87%에서 GMP 컨설턴트 활용을 권고한 점은 매우 두드러진 공통사항이다. 이러한 거의 보편적인 권고는 관찰된 실패 사례들이 개별적·일회성 사건이 아니라, 외부 전문가의 개입 없이는 적절한 시정이 어려운 품질경영시스템(Quality Management System) 전반에 내재된 취약성을 나타낸다는 점을 강조한다.
한편, 일반의약품(OTC) 제조업체는 전체 워닝레터의 11%를 차지하였다.
Created with Datawrapper
Figure 2: Percentage of Warning Letters Citing Data Integrity Issues
워닝레터에서 가장 빈번하게 논의된 21 CFR Part 211의 GMP 조항은 211.84(d)1, (d)2, 211.22(a), (d), 211.100(a), 211.165(a), 그리고 211.192이다.
- 21 CFR 211.84(d)1 및 (d)2는 원료, 완제의약품 용기 및 마개에 대한 시험과 승인 또는 부적합 판정에 관한 조항이다.
(d)1은 완제의약품을 구성하는 각 원료의 동일성(Identity)을 확인하기 위해 최소 1종 이상의 시험을 수행할 것을 요구하며,
(d)2는 각 원료가 순도, 함량, 품질에 관한 모든 적절한 서면 규격에 적합한지를 시험할 것을 요구한다.
- 21 CFR 211.22는 품질관리부서(Quality Control Unit, QCU)의 책임에 관한 조항이다. 특히 211.22(a)는 품질관리부서가 원료, 완제의약품 용기 및 마개, 공정 중 자재, 포장 자재, 표시 자재 및 완제의약품의 승인 또는 부적합 판정에 대한 책임과 권한을 가져야 하며, 생산 기록을 검토하여 오류 발생 여부를 확인하고, 오류가 발생한 경우 해당 사항이 충분히 조사되었는지를 확인할 권한을 보유해야 함을 규정하고 있다. 또한, 다른 회사에 위탁하여 제조, 가공, 포장 또는 보관된 의약품에 대해서도 품질관리부서가 승인 또는 부적합 판정을 책임진다고 명시하고 있다. 한편, 211.22(d)는 품질관리부서에 적용되는 책임과 절차가 문서화 되고, 실제로 준수되어야 함을 명확히 하고 있다.
- 21 CFR 211.100(a)는 완제의약품이 표시되거나 주장하는 동일성, 함량, 품질 및 순도를 보장하기 위해 설계된 생산 및 공정 관리에 관한 서면 절차의 필요성을 규정하고 있다. 이 조항은 공정 밸리데이션의 전 주기 접근법, 즉 PV Stage 1, 2 및 3에 해당하는 GMP 요구사항과 직접적으로 연관된다.
- 21 CFR 211.165(a)는 시험 및 출하 승인에 관한 조항으로, 각 배치의 완제의약품은 출하 전에 유효성분 각각의 동일성과 함량을 포함하여 최종 규격에 적합함을 입증하는 적절한 시험실 시험이 수행되어야 함을 규정하고 있다.
- 21 CFR 211.192는 생산 기록 검토에 관한 조항으로, 포장 및 표시 기록을 포함한 모든 완제의약품의 생산 및 관리 기록은 배치가 출하 또는 유통되기 전에, 확립되고 승인된 모든 서면 절차에 대한 적합성을 판단하기 위해 품질관리부서의 검토 및 승인을 받아야 함을 요구한다. 이론 수율 대비 설정된 최대 또는 최소 허용치를 초과하는 경우를 포함한 모든 설명되지 않은 일탈이나, 배치 또는 그 구성 요소가 규격을 충족하지 못한 경우에는, 해당 배치가 이미 유통되었는지 여부와 관계없이 철저한 조사가 수행되어야 한다. 이러한 조사는 동일한 완제의약품의 다른 배치뿐만 아니라, 해당 실패 또는 불일치와 연관되었을 가능성이 있는 다른 의약품으로까지 확대되어야 한다. 따라서, 과학적으로 타당하고 포괄적인 조사 수행, 그리고 효과적인 시정·예방조치(CAPA)로 이어지는 강건한 근본 원인 분석이 매우 중요하다.
가장 빈번하게 지적된 위반 사항은 원료의 동일성 시험과 관련된 21 CFR 211.84(d)(1)로, 총 49건의 워닝레터에서 인용되었다. 그 다음으로는 순도, 함량 및 품질 시험에 관한 211.84(d)(2)가 41건의 워닝레터에서 지적되었다. 이 두 항목을 종합해 볼 때, 기업은 공급업체 적격성 평가 및 입고 자재 관리 시스템에 대한 전사적(Global) 감사를 최우선 과제로 설정할 필요가 있다.
그 밖의 주요 결함 사항으로는, 밸리데이션된 절차의 수립 및 준수 실패(211.100(a), 33건), 배치 출하 전 시험실 시험의 미흡(211.165(a), 26건), 그리고 생산 기록 검토 및 조사 미흡(211.192, 22건)이 포함된다. 이러한 개별적인 미준수 사항의 이면에는, 품질관리부서의 권한 부족 및 책임 정의 미흡과 같은 품질 시스템 전반의 구조적 취약성이 존재하며, 이는 211.22, 211.22(a), 211.22(b) 조항에서 총 54건의 지적으로 나타났다.
Created with Datawrapper
Figure 3: GMP Sections Cited in Warning Letters. Click on the image to enlarge.
2025년 FDA 워닝레터 데이터는 여러 가지 시사점을 보여준다. 품질관리부서 운영, 시험 관리, 공정 밸리데이션, 조사 수행과 관련된 기존의 취약점들은 여전히 제조업체에게 주요한 장애 요인으로 작용하고 있다. 특히 데이터 완전성 준수 측면에서 지역 간 현저한 격차가 존재하며, 인도 소재 제조시설에서 불균형적으로 높은 지적 비율이 확인되어 데이터 거버넌스 및 관리·감독 문화 측면의 도전 과제를 시사한다.
FDA가 제3자 GMP 컨설턴트 활용을 권고하는 사례가 압도적으로 빈번하다는 점은, 많은 기업이 이러한 구조적 문제를 자체적으로 시정할 수 있는 내부 역량을 충분히 갖추지 못하고 있음을 보여준다. 본 분석은 공급업체 적격성 평가와 입고 시험 프로그램의 체계적 취약성이 워닝레터로 이어질 수 있음을 명확히 한다. 반복적으로 발생하는 규제 미준수로 인해 워닝레터가 발부되고 있는 현실을 고려할 때, 규제 취약성을 해소하기 위한 표적화된 대응 계획의 수립은 리스크 완화를 위해 필수적이다.